ASCO 2025 口头报告:信达生物公布全球首创PD-1/IL-2α-bias双特异性抗体融合蛋白IBI363治疗晚期结直肠癌的临床I期研究数据
美国旧金山和中国苏州 2025年6月2日 /美通社/ -- 信达生物制药集团(香港联交所股票代码:01801),一家致力于研发、生产和销售肿瘤、心血管及代谢、自身免疫、眼科等重大疾病领域创新药物的生物制药公司,在2025年美国临床肿瘤学会年会(ASCO)上公布了全球首创(First-in-class)PD-1/IL-2α-bias双特异性抗体融合蛋白IBI363单药及联合贝伐珠单抗治疗晚期结直肠癌的临床研究数据。IBI363在传统定义为"免疫冷肿瘤"的结直肠癌中治疗观察到了显著响应和长期生存获益,印证了其独特的免疫激活机制,有望将"冷"肿瘤转变为"热"肿瘤。
目前,信达生物正在中国、美国、澳大利亚同时开展临床研究,探索 IBI363 在免疫耐药、冷肿瘤和前线治疗等多瘤种适应症的有效性和安全性。本次ASCO会议,IBI363在首批探索的非小细胞肺癌、结直肠癌、黑色素瘤三项免疫耐药及冷肿瘤中,报道了令人鼓舞的I/II期临床数据,从肿瘤响应到长期生存获益,全面地展现了IBI363在各适应症的突破性临床研究结果。这是IBI363从创新药物机理到临床转化的扎实验证,并提示其进一步拓展临床开发的潜力,有望为免疫治疗空白的领域带来新希望。
PD-1/IL-2α-bia s 双特异性抗体融合蛋白( IBI363)单药及联合贝伐珠单抗治疗晚期结直肠癌的I期临床研究数据
本次研究数据来自两项I期临床研究(NCT05460767, NCT06717880),旨在评估IBI363单药及联合贝伐珠单抗治疗晚期结直肠癌受试者的安全性、耐受性和初步有效性。
IBI363单药治疗即展现出突破性的抗肿瘤治疗潜力,总生存期 较标准治疗数据显著延长
- 截至2025年4月7日,共68例晚期结直肠癌受试者接受了不同剂量水平(0.1mg/kg-3mg/kg)的单药治疗。无已知的确认为高度微卫星不稳定(MSI-H),或错配修复蛋白缺陷(dMMR)受试者,86.8%的受试者为微卫星稳定(MSS)或错配修复蛋白完整(pMMR)的晚期结直肠癌。61.8%的受试者存在肝转移。63.2%的受试者既往接受过三线或以上的系统性抗肿瘤治疗。23.9%的受试者入组前接受过免疫治疗。
- 接受IBI363单药治疗的患者中(n=68),中位随访时间为20.1个月,中位总生存期(OS)数据优异,达到16.1个月,相较标准治疗的过往研究数据(6.4-9.3个月1-3)有显著延长。
- 亚组分析显示,无论是否有肝转移,患者均显示出优异的 OS,提示显著临床获益。肝转移的受试者(n=42)中位OS为14.4个月,无肝转移的受试者(n=26)为17.0个月。
- 接受IBI363 单药1 mg/kg Q2W治疗患者中(n=22),总体确认的客观缓解率(cORR)为13.6%。
|
肝转移 |
无肝转移 |
总体 (n = 68) |
|
|
中位 OS, 月(95% CI) |
14.4 (8.0, 18.8) |
17.0 (9.9, NC) |
16.1 (10.1, 18.8) |
|
6个月OS率, % (95% CI) |
81.3 (64.6, 90.6) |
80.0 (58.4, 91.1) |
80.7 (68.5, 88.6) |
|
12个月OS率, % (95% CI) |
54.8 (36.9, 69.5) |
59.5 (37.8, 75.8) |
56.6 (43.0, 68.1) |
|
18个月OS率, % (95% CI) |
37.6 (21.3, 53.9) |
44.8 (24.0, 63.6) |
40.3 (27.2, 53.0) |
|
OS中位随访时间, 月(95% CI) |
20.2 (17.9, 20.7) |
20.1 (16.8, 21.7) |
20.1 (17.7, 20.6) |
IBI363联合贝伐珠单抗治疗展现出令人鼓舞的疗效信号及可控安全性,客观缓解率及无进展生存期数据优秀
- 截至2025年4月7日,共73例晚期结直肠癌受试者接受了不同剂量水平(0.6mg/kg-3mg/kg)的IBI363联合贝伐珠单抗治疗。无已知确认为MSI-H或dMMR受试者, 91.8%的受试者为MSS或pMMR的晚期结直肠癌。56.2%的受试者存在肝转移。54.8%的受试者既往接受过三线或以上的系统性抗肿瘤治疗。16.4%的受试者入组前接受过免疫治疗。
- 接受联合治疗的患者中(n=73),cORR为15.1%,疾病控制率(DCR)为61.6%。无进展生存期(PFS)中位随访时间为9.9个月, PFS达4.7个月。OS中位随访时间为9.4个月,OS未成熟,仅观察到13例事件(17.8%)。
- 亚组分析显示,接受联合治疗无肝转移受试者中(n=32), cORR为31.3%,DCR为81.3%。中位PFS达7.4个月。接受IBI363 3mg/kg Q3W联合治疗的受试者中(n=31),cORR和DCR分别提高至19.4%和71.0%,中位PFS达5.6个月。
|
无肝转移 |
IBI363 3 mg/kg Q3W联合贝伐珠单抗 (n = 31) |
总体 (n = 73) |
|
|
确认的 ORR, % (95% CI) |
31.3 (16.1, 50.0) |
19.4 (7.5, 37.5) |
15.1 (7.8, 25.4) |
|
DCR, % (95% CI) |
81.3 (63.6, 92.8) |
71.0 (52.0, 85.8) |
61.6 (49.5, 72.8) |
|
中位 PFS, 月 (95% CI) |
7.4 (4.1, 9.8) |
5.6 (2.5,6.8) |
4.7 (2.5,6.7) |
|
PFS中位随访时间, 月 (95% CI) |
9.9 (7.2, 13.1) |
8.6 (7.2, 10.2) |
9.9 (7.2, 13.9) |
安全性方面,在接受单药和联合治疗受试者中,分别有19例(27.9%)和26例(35.6%)报告了3级及以上的治疗相关不良事件(TRAEs)。最常见TRAE是关节痛、贫血、皮疹和甲状腺功能减退。 IBI363单药治疗以及IBI363与贝伐珠单抗联合治疗均具有可接受的安全性特征,未观察到新的安全性信号。
肿瘤免疫细胞浸润分析支持 IBI363的将"冷肿瘤变热"的作用机制, 基线肿瘤组织中PD1 ⁺ CD25 ⁺ CD8 ⁺ 细胞的富集与 临床疗效相关
- 在基线肿瘤组织中的CD8⁺细胞、CD25⁺CD8⁺细胞和PD1⁺CD25⁺CD8⁺细胞的浸润水平升高与对IBI363单药治疗的临床反应改善(部分缓解或疾病稳定)相关。这在作用机制角度支持了IBI363在结直肠癌治疗中具有潜力的抗肿瘤效应。
华中科技大学同济医学院协和医院张涛教授表示:"结直肠癌是严重危害人类健康的消化系统常见恶性肿瘤。在世界范围内结直肠癌发病率位居恶性肿瘤的第三位,死亡率位居恶性肿瘤的第四位4。约86%结直肠癌处于免疫荒漠或免疫炎症抑制状态,传统ICIs治疗无效5。对于标准治疗失败的结直肠癌,治疗手段有限,生存期短,存在巨大的未满足临床需求6。IBI363作为PD-1/IL-2α-bias双特异性分子,通过有效扩增肿瘤特异性CD8⁺ T细胞(TST细胞),在临床前研究中展现出强大的抗肿瘤效果。其阻断PD-1和刺激TST细胞的能力,有望将'冷'肿瘤转变为'热'肿瘤。IBI363单药在后线治疗的中位生存期可达16.1个月,对比于当前标准治疗方案的中位生存期有显著的提升,也证明其作为PD1+细胞因子双抗免疫疗法潜在强大的'拖尾效应'。IBI363联合贝伐治疗组仍在持续随访,已显示出具有潜力的疗效及可耐受安全性,特别在无肝转移亚群中显示出独特的疗效特征。总体而言,已有的临床数据提示IBI363联合贝伐在结直肠癌人群具有充分的开发前景,值得进一步探索其临床价值。"
信达生物制药集团高级副总裁周辉博士表示:"在2024年ASCO及ESMO报道的数据基础上,本次ASCO年会我们从ORR,PFS和OS及亚组分析等综合维度上更全面地展现了IBI363单药及联合疗法,在非MSI-H/dMMR晚期结直肠癌中展现了突破性的抗肿瘤活性,同时我们也期待高剂量组更长随访时间下的生存获益进一步成熟。IBI363针对晚期结直肠癌的关键研究计划正在准备中。同时,在传统定义为‘免疫冷肿瘤'的结直肠癌群体中观察到显著响应和长期生存获益,不仅印证了IBI363独特的免疫激活机制,更进一步提示了IBI363广谱开发潜力,有望为更多免疫治疗空白乃至更广泛的治疗领域带来希望。"
关于 IBI363(PD-1/IL-2α-bias双特异性抗体融合蛋白)
IBI363是由信达生物自主研发的全球首创PD-1/IL-2α-bias双特异性融合蛋白,同时具有阻断PD-1/PD-L1通路和激活IL-2通路两项功能。IBI363的IL-2臂经过了设计改造,保留了其对IL-2 Rα的亲和力,但削弱了对IL-2Rβ和IL-2Rγ的结合能力,以此降低毒性;而PD-1结合臂可以同时实现对PD-1的阻断和IL-2的选择性递送。由于新激活的肿瘤特异性T细胞同时表达PD-1和IL-2α,这一差异性策略可以更精确和有效地实现对该T细胞亚群的靶向和激活。IBI363不仅在多种荷瘤药理学模型中展现出了良好抗肿瘤活性,在PD-1耐药和转移模型中也表现出了突出的抑瘤效力。
从临床迫切需求出发,信达生物正在中国、美国、澳大利亚开展临床研究探索IBI363在针对各种恶性肿瘤的有效性和安全性。IBI363已开出首个关键注册临床研究,用于治疗未经免疫治疗的粘膜型和肢端型黑色素瘤。
IBI363已获美国FDA两项快速通道资格认定,分别用于治疗晚期鳞状非小细胞肺癌和黑色素瘤。IBI363也获得中国NMPA纳入两项突破性疗法认证,治疗晚期黑色素瘤和鳞状非小细胞肺癌。
- 《LEGEND BATTLES》虚幻引擎5.5驱动的400km²次世代超现实大逃杀游戏来袭
- 霍尼韦尔与华龙航空签署合作备忘录 深化合作伙伴关系
- 奥动「轻卡30秒极速换电站」重磅首发钓鱼台
- TÜV莱茵出席2024年世界职业技术教育发展大会暨联盟成立仪式
- 巨峰葡萄缀满藤,钱大妈基地直采正当时
- DHL快递中国区连续第七年向国内公益机构捐款,支持公益事业发展
- 卡西欧MR-G系列将推新款MRG-B2100B
- 北京邮电大学-法国里昂商学院 EMBA(中外合作办学)项目2024级春季班开学典礼隆重举行
- TÜV莱茵与CBIA达成战略合作 推进中国电池数字护照体系建设
- 2025上海车展 | 移远通信DynaBlue蓝牙协议栈量产落地,赋能智能座舱无缝互联新生态
- 魅力女鞋,步出中国风尚——探寻中国女鞋的独特魅力
- 品牌出海!舒华体育亮相IHRSA Fitness Brasil 2024,彰显品牌国际实力
- 华为在迪拜举行"揭开经典"发布会,开启折叠屏卓越新时代
- 信达生物IBI343 (CLDN 18.2 ADC) 获国家药品监督管理局纳入突破性治疗药物品种,治疗晚期胰腺导管腺癌患者
- 中国包装:传承与创新,展现独特魅力
- 培养青年创新意识,"高校知识产权公开课"走进上海
- 6月4-6日管道行业盛会来袭:高峰论坛合集,一键收藏
- 美赞臣携手中国儿基会启动第三期乡村母婴营养改善计划
- 上海康莱德酒店共庆主厨季五周年
- 万怡酒店品牌持续拓展大湾区 顺德美的万怡酒店正式启幕
- SGS领航新型储能安全赛道 绿色智能方案亮相第十三届储能展
- 阿布扎比敞开通往其最新文化地标的大门: teamLab Phenomena Abu Dhabi
- 仲量科技 | 以智慧化解决方案,赋能商业地产的可持续发展
- 艺卓参展第91届CMEF 创新产品集结亮相
- 跨境社交电商吉宏股份拟赴港上市 国际化布局跑出发展加速度
- 美中宜和医疗集团第三届医生沙龙暨18周年医生答谢庆典圆满举办
- 流感创新药速福达®实现本地化分包装生产 更快惠及中国流感患者
- 天为地用 地为天用----自然堂正式发布太空酵母护肤研究计划
- Omdia:到2027年,全球人型机器人出货量将超过10,000台,2030年将达到38,000台
- Advanced Drone Frames with Custom Carbon Fiber Sheets
推荐
-
 我们时常把创业想得太过简单,认为获得成功轻而易举
我们时常把创业想得太过简单,认为获得成功
财商
我们时常把创业想得太过简单,认为获得成功轻而易举
我们时常把创业想得太过简单,认为获得成功
财商
-
 春节将至,抢票再次成为广大网友关注的热门话题
春节将至,抢票再次成为广大网友关注的热门话
财商
春节将至,抢票再次成为广大网友关注的热门话题
春节将至,抢票再次成为广大网友关注的热门话
财商
-
 广东省药监局调研恒昌医药集团,聚焦药品流通产业高质量发展
日前,广东省药品监督管理局党组成员、副
财商
广东省药监局调研恒昌医药集团,聚焦药品流通产业高质量发展
日前,广东省药品监督管理局党组成员、副
财商
-
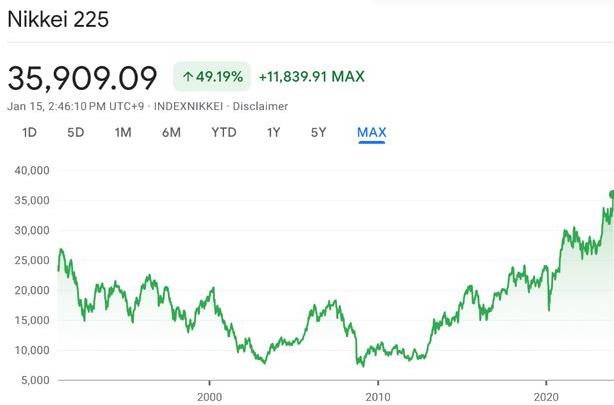 日股盘中再破34年新高,今年还涨得动吗?
今年日股开局强势,1月5日以来开启连涨行情,日
财商
日股盘中再破34年新高,今年还涨得动吗?
今年日股开局强势,1月5日以来开启连涨行情,日
财商
-
 为何娃哈哈纯净水线上会卖断货?
随着网络上关于娃哈哈和农夫山泉之争的持续
财商
为何娃哈哈纯净水线上会卖断货?
随着网络上关于娃哈哈和农夫山泉之争的持续
财商
-
 娃哈哈这艘商业巨舰将驶向何方,我们试目以待
2月25日,娃哈哈集团在官网发布讣告,娃哈哈创
财商
娃哈哈这艘商业巨舰将驶向何方,我们试目以待
2月25日,娃哈哈集团在官网发布讣告,娃哈哈创
财商
-
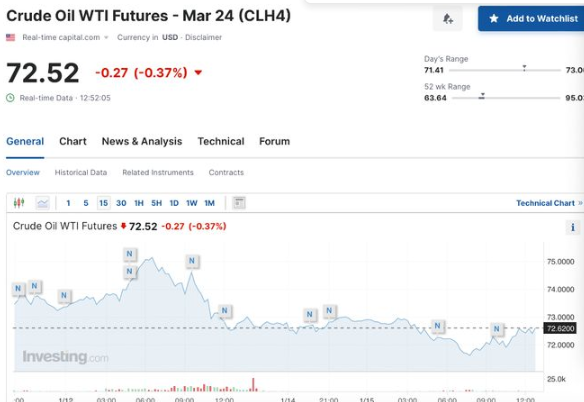 供应“安全感”超过红海“危机感”?欧洲天然气价格大跌
虽然冬季极寒天气来临,而且卡塔尔似乎已经暂
财商
供应“安全感”超过红海“危机感”?欧洲天然气价格大跌
虽然冬季极寒天气来临,而且卡塔尔似乎已经暂
财商

